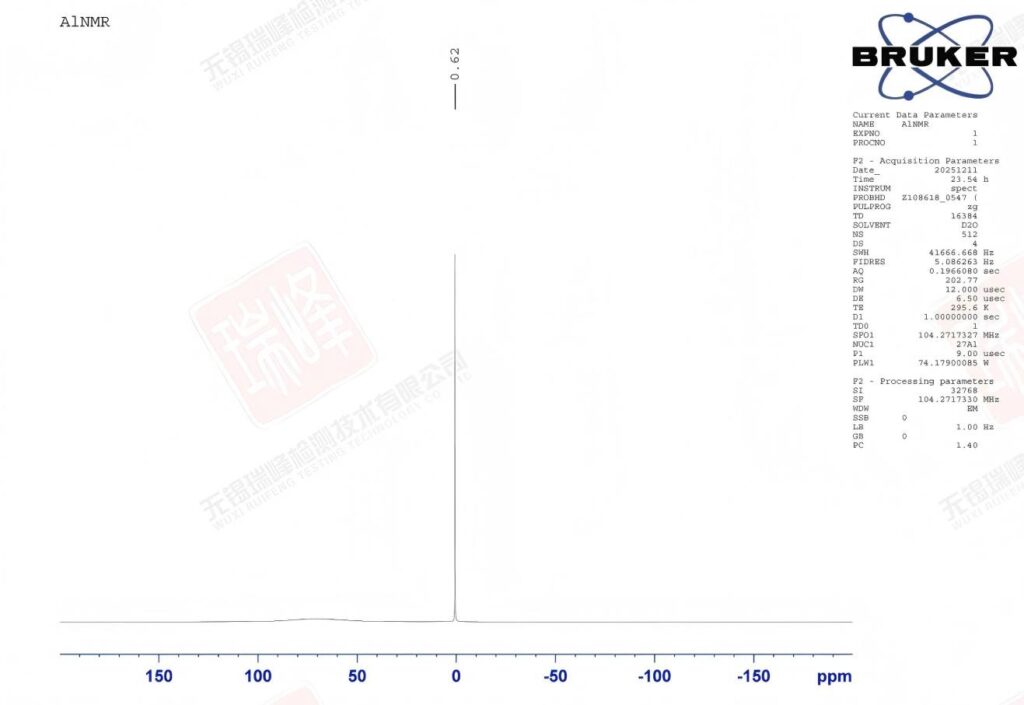
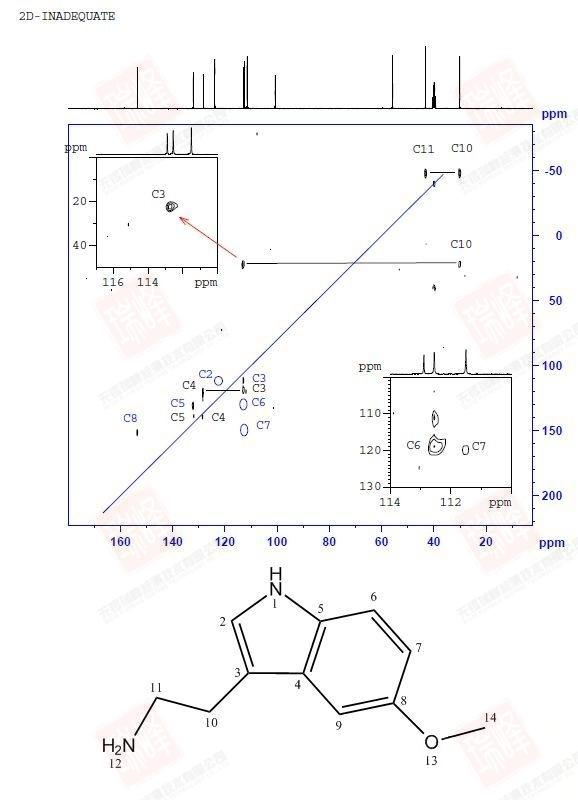
锌元素在自然界中有五个稳定同位素,但只有⁶⁷Zn具有核自旋(I = 5/2),是NMR可观测的。然而,⁶⁷Zn的NMR实验面临多重固有困难:
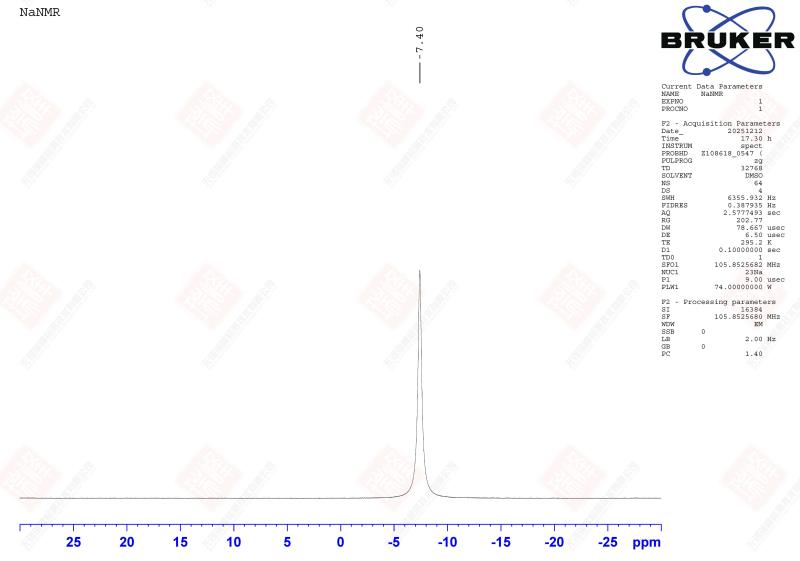
宽的化学位移范围与参考问题:⁶⁷Zn的化学位移范围极宽(超过1000 ppm),这有利于区分不同化学环境,但也对仪器的频率锁定和化学位移参照提出了挑战。通常使用0.1 M Zn(ClO₄)₂水溶液(酸性以防止水解)作为外标(δ = 0 ppm)。
极低的天然丰度和旋磁比:⁶⁷Zn的天然丰度仅为4.3%,其旋磁比(γ)非常小,约是¹H的1/6。这直接导致其固有灵敏度极低,理论上只有¹H的约1.4×10⁻⁶。探测信号如同大海捞针。
四极矩弛豫带来的信号展宽:⁶⁷Zn具有较大的四极矩(Q)。在非球对称的电荷环境(即所有非立方对称的配位场)中,四极弛豫机制占主导,导致共振峰严重展宽,峰值信号强度急剧下降。对于配位环境变化敏感的弛豫特性,既是分析的难点,也是信息的来源。
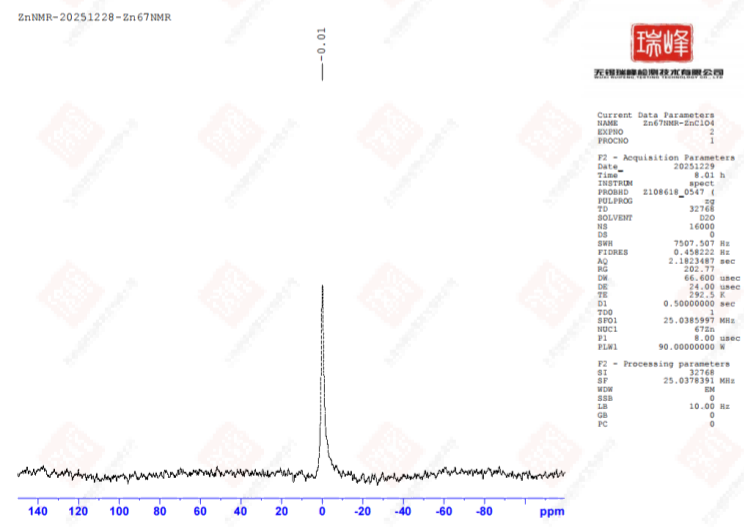
上图为我公司400MHz核磁所做的核磁共振⁶⁷ZnNMR实验,可以看到即使在16000次的扫描次数下,⁶⁷Zn的核磁信号依然不是很强(注意,处理参数中的LB值调到了10!),且呈现了较为明显的展宽效应。
近些年,在能源材料领域,⁶⁷ZnNMR越来越多被使用在用来观测水系锌离子电池电解液的溶剂化结构。